Buongiorno, è possibile applicare la metodologia di laboratorio povero ad altre scienze, quali chimica e biologia?
Buongiorno, è possibile applicare la metodologia di laboratorio povero ad altre scienze, quali chimica e biologia?
Oggi vi mostro un percorso didattico laboratoriale di tipo povero, proposto nel mio TFA A059 presso l'Università di Padova, rivolto a studenti di terza media. L'attività didattica è a cavallo tra chimica e Fisica, facilmente riproducibile anche senza avere laboratori attrezzati, permette di trattare il tema dell'elettrolisi e la corrente elettrica realizzando anche una pila con dei comunissimi limoni.
Per dubbi, suggerimenti, per realizzare tale attività o per proporne altre scrivitemi ad Questo indirizzo email è protetto dagli spambots. È necessario abilitare JavaScript per vederlo.
Vi allego la bozza del progetto contenente risorse prese da internet o da libri di testo.
TITOLO E TEMA DEL PROGETTO
L'ELETTROLISI E LA CORRENTE ELETTRICA
OBIETTIVO DEL CICLO DI LEZIONI
Obiettivi specifici di apprendimento: saper scrivere una relazione di laboratorio, conoscere le leggi sull'idrolisi, saper distinguere anodo e catodo, sapere le soluzioni elettrolitiche e non, conoscere il principio di funzionamento di una Pila, saper scrivere almeno una reazione chimica in soluzione elettrolitica
Obiettivi relazionali: saper lavorare in gruppo, saper prendere appunti in laboratorio, sviluppare un processo in zona di sviluppo prossimale in relazione ai laboratori poveri
CONOSCENZE PROPEDEUTICHE
La carica elettrica, la struttura atomica, la nomenclatura di semplici molecole, acidi e basi, le leggi di Ohm, il potenziale elettrico, la resistenza elettrica, gli ioni, I legami chimici
ARTICOLAZIONE DEL CICLO
Tempi:
fase 0 : laboratorio povero a casa sull'elettrostatica
fase 2: esperimenti sull'elettrolisi
fase 3: l'elettrolisi dell'acqua
fase 4: lezione frontale, utilizzo delle TIC
fase 5: la pila daniell
fase 6: verifica finale
Contenuti
l'elettrolisi, l'elettrolisi dell'acqua, le pile, le celle elettrolitiche
DESCRIZIONE E CONTESTUALIZZAZIONE DELL'ESPERIMENTO.
1 parte: laboratorio povero a casa
Avvicina una bacchetta elettrizzata (anche per strofinio) vicino ad un filo di acqua che scorre (es. dal rubinetto) ed osserva cosa accade. L'acqua è quindi un buon conduttore di corrente? Perchè viene deviata?
2 parte:
La prima parte della lezione (2 ore circa) inizia con un set di esperimenti da svolgere nel laboratorio della scuola.
La scelta di iniziare subito con un laboratorio è perchè preferisco dare una impronta fortemente sperimentale a questa unità.
Gli studenti partono dal laboratorio a scuola per costruire un modello teorico concettuale sull'elettrolisi.
Esperimenti
Le sostanze che, se disciolte in acqua o allo stato fuso, conducono la corrente elettrica vengono chiamate elettroliti. Prendiamo un solido tenuto assieme da legami di Van der Waals come una semplice zolletta di zucchero: gli elettroni sono tutti confinati all'interno della molecola di glucosio, non vi è possibilità che conducano corrente e quindi (vedi fotografia) la lampadina non si accende
Sciogliendo la zolletta di zucchero in acqua e ponendovi due elettrodi collegati alla solita lampadina, si vede che essa non si accende. Ne consegue che le molecole di glucosio non si ionizzano una volta disciolte in acqua, e dunque non possono condurre la corrente elettrica. Lo zucchero non è un elettrolita.
Si noti che una sostanza può condurre corrente quando è in soluzione ma non allo stato solido. Prendiamo in considerazione del cloruro di sodio (sale da cucina, NaCl), versiamone un po' su un frammento di carta ed infiliamo in esso gli elettrodi. Si constata facilmente che il solido ionico non conduce corrente perchè gli ioni sono intrappolati nella struttura cristallina.Tuttavia, disciogliendo lo stesso sale in un becker di acqua, si verifica facilmente che esso conduce la corrente perchè la lampadina si è accesa. Infatti il cristallo di cloruro di sodio si dissolve in acqua e gli ioni liberi possono trasportare la corrente da un elettrodo all'altro. Il sale dunque è un elettrolita. In tema di conducibilità, questa è la semplicissima apparecchiatura da banco detta conducimetro a comparazione ottica per dimostrare intuitivamente la diversa conduzione delle varie soluzioni. Basta versare le soluzioni nei rispettivi bicchierini dotati di elettrodi, per vedere le lampadine accendersi con differente intensità a seconda della concentrazione di ioni nella soluzione. Se nei bicchierini verso per es. acido cloridrico ed acido acetico, quest' ultimo farà illuminare la lampadina assai meno del primo, visto che è molto meno forte dell'HCl. Un altro esempio di una reazione favorita dal passaggio di corrente elettrica. In questo caso nel becker è stata posta una miscela elettrolitica di acqua e cloruro di sodio, il comune sale da cucina (NaCl); in esso poi sono stati immersi una lastrina di rame, collegata al polo positivo della pila, e un catodo che chiude il circuito (il cavo nero è collegato al polo negativo della pila). Dopo breve tempo, il becker appare invaso da una soluzione di colore verde. Come mai?
Scheda di lavoro di laboratorio
Osserva gli esperimenti che svolgiamo in laboratorio e prendi tutti gli appunti necessari.
…..................................................................................................................................................................................................................................................................…..................................................................................................................................................................................................................................................................…..................................................................................................................................................................................................................................................................…..................................................................................................................................................................................................................................................................….....................................................................................................................................................................................................................................................................................................................................................................................................…..................................................................................................................................................................................................................................................................…..................................................................................................................................................................................................................................................................…..................................................................................................................................................................................................................................................................…..................................................................................................................................................................................................................................................................…..................................................................................................................................................................................................................................................................
Rispondi alle seguenti domande, anche aiutandoti con il libro di testo.
Perchè lo zucchero e il sale solidi non conducono elettricità?
…..................................................................................................................................................................................................................................................................…..................................................................................................................................................................................................................................................................…...............................................................................................................................
Perchè lo zucchero sciolto in acqua non conduce corrente e il sale sì?
…..................................................................................................................................................................................................................................................................…..................................................................................................................................................................................................................................................................…...............................................................................................................................
Perchè nella miscela elettrolita di acqua , cloruro di sodio , la barretta di rame si erode?
Cosa potrebbe accadere secondo te?
…..................................................................................................................................................................................................................................................................…..................................................................................................................................................................................................................................................................
3 parte
Lezione teorica, utilizzando la LIM
Argomento : idrolisi e i vari tipi di Pile
Vengono richiamati e spiegati i concetti visti in laboratorio e se ne aggiungono di nuovi
Applet reperibili qui:
http://myweb.tiscali.co.uk/chemteach/swf/electrolysis2.swf
Vengono introdotte le seguenti Keywords: catodo, anodo, elettrodi, cella elettrolitica, soluzione elettrolitica, cationi e anioni, grado di dissociazione, leggi di Faraday sull'elettrolisi, Pila di Volta, accumulatori, sali, reticoli cristallini.
4 Parte
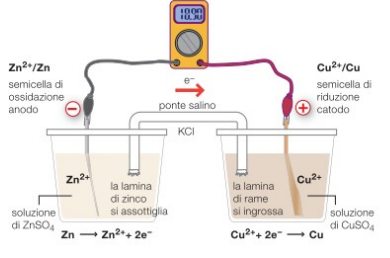
Laboratorio: La pila Daniell
Viene presentata la Pila daniell (cella Zn e Cu e cella Mg Cu)
La lezione è anche reperibile su: http://www.itchiavari.org/chimica/lab/daniell.html
Relazione di laboratorio:
Gruppo:
Materiale occorrente:
…........................................................................................................................…..................................................................................................................................................................................................................................................................…..................................................................................................................................................................................................................................................................
…..................................................................................................................................................................................................................................................................…..................................................................................................................................................................................................................................................................
Osservazione e considerazioni:
In particolare soffermandosi su chi funge da anodo e catodo, sulla differenza di potenziali, sulle concentrazioni usati
…..................................................................................................................................................................................................................................................................…..................................................................................................................................................................................................................................................................…..................................................................................................................................................................................................................................................................
Parte 5
Laboratorio a casa: La pila al limone
Fase 6
Verifica finale
1) descrivi il principio di funzionamento di una pila (es. Pila Daniell)
…..................................................................................................................................................................................................................................................................…...............................................................................................................................
2) Descrivi (a parte la pila) un esperimento di laboratorio che ti ha colpito maggiormente e descrivine la procedura e le conseguenze sperimentali .
...................................................................................................................................…...............................................................................................................................
3) Enuncia le leggi di Faraday sull'elettrolisi
...................................................................................................................................
4) Descrivi brevemente cosa si intende per idrolisi dell'acqua
...................................................................................................................................
5) 5 domande a risposta multipla in relazione agli strumenti e agli esperimenti visti in classe